Đề thi Học kì 2 Hóa 10 có đáp án - Đề 5
Đề thi Học kì 2 Hóa 10 có đáp án- Đề 5
ĐỀ BÀI
I. Trắc nghiệm (3,0 điểm)
Câu 1: Phương pháp nào sau đây dùng để điều chế khí oxi trong phòng thí nghiệm?
A. Điện phân nước
B. Nhiệt phân KClO3(xt MnO2)
C. Chưng cất phân đoạn không khí lỏng
D. Nhiệt phân CuSO4
Câu 2: Sục 11,2 lít khí SO2 vào 300 ml dung dịch NaOH 2M thu được dung dịch X. Dung dịch X gồm
A. NaHSO3, Na2SO3
B. NaHSO3, Na2SO3, NaOH
C. NaOH, Na2SO3
D. NaOH, NaHSO3
Câu 3: Cho sơ đồ phản ứng sau: KClO3 + HCl đặc → KCl + Cl2 + H2O.
Tổng hệ số tối giản của các chất tham gia phản ứng là
A. 7
B. 10
C. 12
D. 14
Câu 4: Dãy chất nào sau đây đều tác dụng được với dung dịch H2SO4 loãng?
A. Fe, BaCl2, CuO, Ag, Al
B. Zn, Fe(OH)2, FeO, HCl, Au
C. CaCl2, K2O, Cu, Mg(OH)2, Mg
D. Al(OH)3, ZnO, BaCl2, Mg, Na2CO3
Câu 5: Khí nào sau đây có màu vàng lục?
A. F2
B. O2
C. Cl2
D. SO2
Câu 6: Chất A là muối canxi halogenua (CaX2). Cho dung dịch chứa 0,2 gam A tác dụng vừa đủ với dung dịch AgNO3 thu được 0,376 gam kết tủa. Công thức của phân tử A là
A. CaCl2
B. CaBr2
C. CaI2
D. CaF2
II – Tự luận (7 điểm)
Bài 1 (2,5 điểm)
Hoàn thành phương trình hóa học của các phản ứng sau (ghi rõ điều kiện phản ứng nếu có).
A. Al +H2SO4 loãng →
B. H2S + O2(thiếu) →
C. Fe + Cl2 →
D. SO2 + Br2 + H2O →
E. FeS + H2SO4 đặc, nóng
Bài 2 (1,5 điểm)
Bằng phương pháp hóa học hãy phân biệt các dung dịch mất nhãn riêng biệt sau (viết các phương trình hóa học xảy ra nếu có): NaNO3; K2S; Na2SO4; MgCl2
Bài 3 (3 điểm)
Hòa tan hoàn toàn 22,8 gam hỗn hợp A gồm Fe và Mg trong 160 gam dung dịch H2SO4 đặc, nóng, vừa đủ. Sau phản ứng xảy ra hoàn toàn, thấy thoát ra 15,68 lít khí SO2 duy nhất (ở đktc) và dung dịch B.
a. Tính thành phần % khối lượng mỗi kim loại trong A. (1,5điểm)
b. Tính C% mỗi chất trong dung dịch B.(1điểm)
c. Nung nóng 1/2 hỗn hợp A với 1,68 lít oxi (đktc) thu được hỗn hợp rắn X. Cho toàn bộ rắn X phản ứng với dung dịch H2SO4 đặc, nóng, dư thu được V lít khí SO2 (đktc). (Các phản ứng xảy ra hoàn toàn).
Tìm V? (0,5điểm)
(Cho: Fe =56; Mg=24; O=16; H =1; Cl =35,5; Na=23; O=16; S=32; Ca=40; F=9; Cl=35,5; Br=80; I=127;Ag=108)
(Học sinh không được sử dụng Bảng tuần hoàn)
ĐÁP ÁN VÀ BIỂU ĐIỂM
I. Trắc nghiệm (3 điểm)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
B |
A |
A |
D |
C |
B |
II. Tự luận (7 điểm)
Bài 1: (2,5 điểm). Mỗi phương trình đúng được 0,5 điểm.Thiếu cân bằng và điều kiện phản ứng trừ 0,25 điểm.
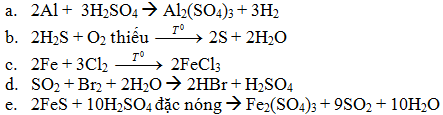
Bài 2: (1,5 điểm). Lấy mỗi chất một ít ra các ống nghiệm riêng biệt rồi đánh số từ 1-4
|
|
NaNO3 |
K2S |
Na2SO4 |
MgCl2 |
|
DD BaCl2 |
- |
- |
Kết tủa trắng |
- |
|
DD AgNO3 |
- (Còn lại) |
Kết tủa đen |
X |
Kết tủa trắng |
PTHH
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
2AgNO3 + K2S → Ag2S + 2KNO3
2AgNO3 + MgCl2 → Mg(NO3)2 + 2AgCl
Các phương pháp nhận biết khác nếu đúng vẫn được điểm tối đa.
Bài 3: (3 điểm)
|
a. (1,5 đ) 2Fe +6H2SO4 đặc nóng → Fe2(SO4)3 +3SO2 + 2H2O x 3x x/2 1,5x (mol) Mg +2H2SO4 đặc nóng → MgSO4 +SO2 + 2H2O y 2y y y (mol) |
0,5đ
|
|
|
|
|
Gọi số mol Fe và Mg lần lượt là x và y (mol) → mA=56x+24y=22,8 (g) (1) nSO2=0,7(mol) => 1,5x + y = 0,7 mol (2) Giải hpt (1) và (2) → x=0,3; y=0,25 (mol) %mFe=73,68%; %mMg=26,32%
|
1đ |
|
b. (1đ) mddB = 22,8 + 1600 – 0,7.64 =138 g C% Fe2(SO4)3 =43,48 %; C% MgSO4 =21,74 % |
1đ |
|
c. (0,5đ) Bản chất của 2 quá trình xảy ra như sau: Fe0 → Fe+3 +3e O2 + 4e → 2O-2 0,15 0,45 0,075 0,3 Mg0 → Mg+2 +2e S+6 + 2e → S+4 0,125 0,25 2a a Theo định luật bảo toàn e ta có PT: 0,45 + 0,25 =0,3 + 2a ↔ a=0,2 Số mol của SO2 = số mol của S+4 = 0,2 mol Thể tích của SO2= 0,2. 22,4= 4,48 lít |
0,5đ |